Teoría de Propiedades Coligativas: Todo lo que necesitas saber
¿Quieres conocer la clave para entender las propiedades coligativas teoria? ¡No busques más! En este artículo te explicaremos todo lo que necesitas saber para dominar este tema y destacar en tus clases de química. Descubre cómo estas propiedades afectan las soluciones y cómo puedes calcularlas de manera sencilla. ¡Prepárate para impresionar a tu profesor y a tus compañeros de clase con tus conocimientos sobre las propiedades coligativas teoria!

Propiedades coligativas: Descubre las 4 fundamentales
Las propiedades coligativas son aquellas que dependen de la cantidad de partículas que estén presentes en una solución y no de su naturaleza. Estas propiedades son muy importantes en la química y tienen diversas aplicaciones en la vida cotidiana. En este artículo, te explicaremos las 4 propiedades coligativas fundamentales y su teoría.
1. Descenso crioscópico
El descenso crioscópico es una propiedad coligativa que se refiere al descenso de la temperatura de congelación de una solución en comparación con la de su solvente puro. Esto se debe a que las partículas disueltas en la solución impiden la formación de cristales en la misma proporción que si estuvieran disueltas en el solvente puro.
La fórmula para calcular el descenso crioscópico es:
ΔTc = Kc · m · i
- ΔTc: descenso crioscópico
- Kc: constante crioscópica (depende del solvente)
- m: molalidad de la solución (moles de soluto por kilogramo de solvente)
- i: factor de Van ‘t Hoff, que indica el número de partículas en solución
2. Elevación ebulloscópica
La elevación ebulloscópica es una propiedad coligativa que se refiere al aumento de la temperatura de ebullición de una solución en comparación con la de su solvente puro. Esto se debe a que las partículas disueltas en la solución elevan la presión de vapor de la misma proporción que si estuvieran disueltas en el solvente puro.
La fórmula para calcular la elevación ebulloscópica es:
ΔTe = Ke · m · i
- ΔTe: elevación ebulloscópica
- Ke: constante ebulloscópica (depende del solvente)
- m: molalidad de la solución (moles de soluto por kilogramo de solvente)
- i: factor de Van ‘t Hoff, que indica el número de partículas en solución
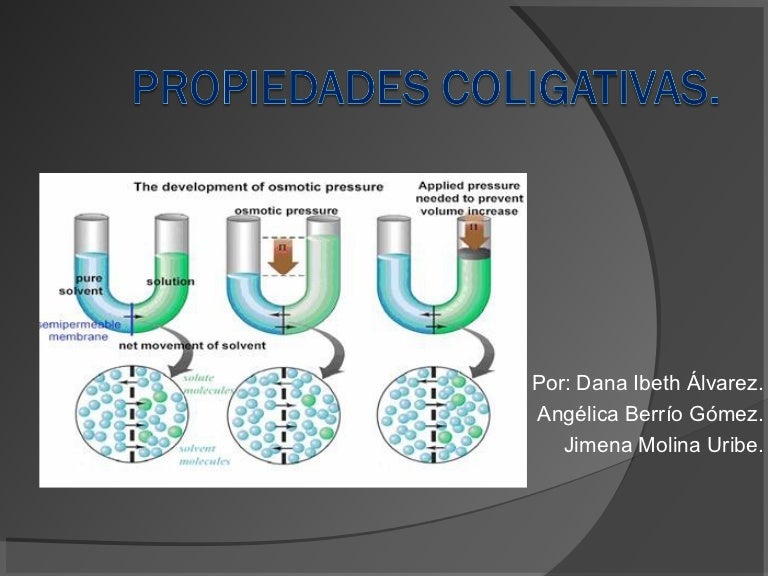
3. Presión osmótica
La presión osmótica es una propiedad coligativa que se refiere a la presión que se debe aplicar a una solución para evitar que el solvente puro entre en ella a través de una membrana semipermeable. Esto se debe a que las partículas disueltas en la solución crean una presión que equilibra la presión del solvente puro.
La fórmula para calcular la presión osmótica es:
π = RT · c · i
- π: presión osmótica
- R: constante de los gases ideales
- T: temperatura en Kelvin
- c: concentración molar de la solución (moles de soluto por litro de solvente)
- i: factor de Van ‘t Hoff, que indica el número de partículas en solución
Descubridor de Propiedades Coligativas: ¿Quién los Identificó?
Las propiedades coligativas son aquellas que se presentan en las soluciones químicas y que dependen únicamente del número de partículas que están presentes en la solución, sin importar la naturaleza química de estas partículas. Las propiedades coligativas más comunes son la presión de vapor, el descenso crioscópico, la elevación ebulloscópica y la presión osmótica. Estas propiedades son muy importantes en química, ya que se utilizan para determinar la masa molecular de un soluto desconocido y para entender la formación de soluciones en general.
El descubrimiento de las propiedades coligativas se atribuye al químico francés François Raoult, quien en el siglo XIX realizó una serie de experimentos en los que estudió el efecto de los solutos sobre el punto de congelación y de ebullición de las soluciones. A partir de estos experimentos, Raoult postuló la ley de Raoult, que establece que la presión de vapor de un componente de una solución ideal es igual a la presión de vapor del componente puro multiplicada por la fracción molar de ese componente en la solución.
La ley de Raoult es una de las bases fundamentales de la química de soluciones y es una herramienta crucial para entender el comportamiento de los líquidos en solución. Además, esta ley es una consecuencia directa de las propiedades coligativas, lo que demuestra la importancia de estas en la química.
Gracias a la ley de Raoult y a las propiedades coligativas, la química ha avanzado significativamente en el campo de las soluciones y se ha podido determinar la masa molecular de muchos compuestos desconocidos.
- Propiedades coligativas: propiedades que se presentan en las soluciones químicas y que dependen únicamente del número de partículas que están presentes en la solución.
- Presión de vapor: propiedad coligativa que se refiere a la presión que ejerce un vapor en equilibrio con su líquido en una solución.
- Descenso crioscópico: propiedad coligativa que se refiere a la disminución del punto de congelación de una solución respecto al del solvente puro.
- Elevación ebulloscópica: propiedad coligativa que se refiere al aumento del punto de ebullición de una solución respecto al del solvente puro.
- Presión osmótica: propiedad coligativa que se refiere a la presión necesaria para detener el flujo de solvente a través de una membrana semipermeable.
- François Raoult: químico francés que descubrió las propiedades coligativas y postuló la ley de Raoult.
- Ley de Raoult: ley que establece que la presión de vapor de un componente de una solución ideal es igual a la presión de vapor del componente puro multiplicada por la fracción molar de ese componente en la solución.

Propiedades coligativas: ¿Qué son y cómo descargar PDF explicativo?
Propiedades coligativas: ¿Qué son y cómo descargar PDF explicativo?
Las propiedades coligativas son aquellas que dependen únicamente del número de partículas disueltas en un disolvente, y no de la naturaleza de dichas partículas. Estas propiedades se utilizan para estudiar el comportamiento de las soluciones, y tienen aplicaciones en diversos campos como la química, la biología y la medicina.
A continuación, te explicamos las cuatro propiedades coligativas más importantes:
1. Bajada del punto de congelación: es la disminución de la temperatura de congelación de un disolvente cuando se le añaden solutos no volátiles. Esto se debe a que los solutos interfieren en la formación de los cristales de hielo.
2. Elevación del punto de ebullición: es el aumento de la temperatura de ebullición de un disolvente cuando se le añaden solutos no volátiles. Esto se debe a que los solutos aumentan la presión de vapor del disolvente.
3. Presión osmótica: es la presión necesaria para detener el proceso de osmosis en una solución. La osmosis es el movimiento del disolvente desde una solución diluida hacia una solución más concentrada.
4. Presión de vapor: es la presión ejercida por las moléculas de un disolvente en fase gaseosa sobre la superficie de una solución. La presencia de solutos no volátiles reduce la presión de vapor del disolvente.
Si deseas profundizar en el estudio de las propiedades coligativas, te recomendamos descargar nuestro PDF explicativo sobre el tema. En este documento encontrarás información detallada sobre las propiedades mencionadas anteriormente, así como ejemplos y ejercicios resueltos.
Para descargar el PDF, sigue los siguientes pasos:
1. Ingresa a nuestro sitio web.
2. Busca la sección de descargas y haz clic en el enlace del PDF de propiedades coligativas.
3. Espera a que se descargue el archivo.
4. Abre el PDF y comienza a aprender más sobre este interesante tema.Descarga nuestro PDF explicativo para profundizar en el tema y mejorar tus conocimientos en química.
Fórmulas de Propiedades Coligativas: ¡Descúbrelas Aquí!
Las propiedades coligativas son aquellas que dependen únicamente del número de partículas del soluto en una disolución, y no de su naturaleza. Estas propiedades incluyen el descenso crioscópico, el aumento ebulloscópico, la presión osmótica y la tonometría. En este artículo, nos enfocaremos en las fórmulas utilizadas para calcular estas propiedades.
Descenso crioscópico:
El descenso crioscópico es la disminución de la temperatura de congelación de un solvente debido a la adición de un soluto no volátil. La fórmula para calcular el descenso crioscópico es:
ΔTc = Kc · m
- ΔTc: descenso crioscópico, es decir, la disminución de la temperatura de congelación del solvente.
- Kc: constante crioscópica, depende del solvente.
- m: molalidad de la disolución, es decir, la cantidad de moles de soluto por kilogramo de solvente.
Aumento ebulloscópico:
El aumento ebulloscópico es el incremento de la temperatura de ebullición de un solvente debido a la adición de un soluto no volátil. La fórmula para calcular el aumento ebulloscópico es:
ΔTe = Ke · m
- ΔTe: aumento ebulloscópico, es decir, el incremento de la temperatura de ebullición del solvente.
- Ke: constante ebulloscópica, depende del solvente.
- m: molalidad de la disolución, es decir, la cantidad de moles de soluto por kilogramo de solvente.
Presión osmótica:
La presión osmótica es la presión necesaria para detener el flujo de un solvente a través de una membrana semipermeable, que separa una disolución del solvente puro. La fórmula para calcular la presión osmótica es:
π = M · R · T
- π: presión osmótica.
- M: molaridad de la disolución, es decir, la cantidad de moles de soluto por litro de disolución.
- R: constante de los gases ideales.
- T: temperatura absoluta.
Tonometría:
La tonometría es una técnica utilizada para medir la presión osmótica de una disolución. La fórmula para calcular la tonometría es:
π = h · ρ · g
- π: presión osmótica.
- h: altura de la columna de líquido.
- ρ: densidad del líquido.
- g: aceleración debido a la gravedad.Este contenido también puede ser encontrado cuando buscas Propiedades coligativas teoria

TeoriaOnline.com cuenta con un equipo de trabajo al cual llamamos cariñosamente «Teoria Online Team» este es un equipo de trabajo conformado por expertos en distintas áreas del conocimiento, incluyendo filosofía, historia, ciencia, educación, arte, política, psicología, religión, sociedad y evolución, entre otras.
También te puede interesar

La fascinante teoría de la evolución de los dinosaurios: descubre su historia

Transistor: Teoría y Funcionamiento Explicado de Forma Sencilla

Radicales libres y envejecimiento: ¿Cómo afectan a tu salud?

Descubre la Teoría Cinética de la Evolución: Una Explicación Científica

Descubre la Teoría del Caos y el Efecto Mariposa