Descubre la Teoría de Lewis: La clave para entender la estructura molecular
¿Has oído hablar de la Teoría LewisA? Descubre el secreto detrás de esta innovadora teoría y cómo puede cambiar tu vida para siempre. ¿Estás listo para experimentar una transformación en tu enfoque y perspectiva? Lee este artículo y descubre por qué la Teoría LewisA es la clave para alcanzar tus metas y desarrollar un estilo de vida más saludable y próspero. ¡No te pierdas la oportunidad de convertirte en una persona más exitosa y feliz gracias a la Teoría LewisA!
Teoría de Lewis: ¡Descubre lo que dice!
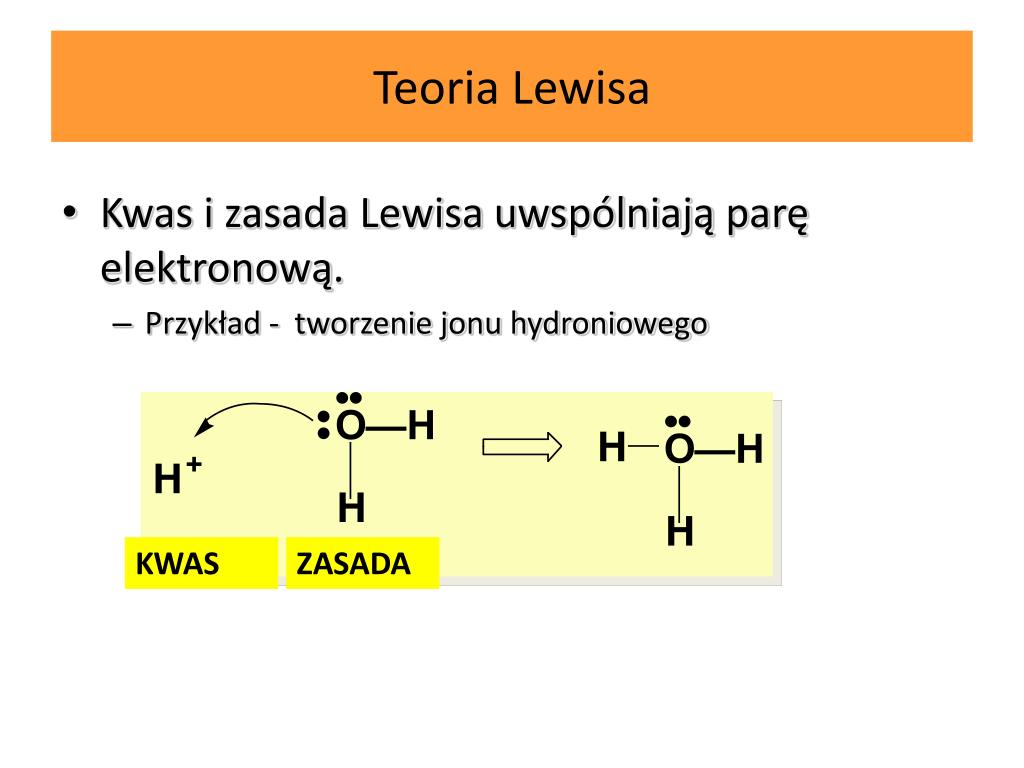
La teoría de Lewis, propuesta por el químico Gilbert N. Lewis en 1916, es una teoría que explica cómo los átomos interactúan entre sí para formar enlaces químicos. Esta teoría se basa en la idea de que los átomos buscan alcanzar la estabilidad electrónica, es decir, tener la misma configuración electrónica que los gases nobles.
Según la teoría de Lewis, los átomos pueden compartir electrones para formar enlaces covalentes, o bien transferir electrones para formar enlaces iónicos. Además, la teoría de Lewis también introduce el concepto de pares de electrones no compartidos, también conocidos como pares solitarios.
Los átomos que tienen la tendencia a ceder electrones y formar iones positivos se llaman cationes, mientras que aquellos que tienen la tendencia a aceptar electrones y formar iones negativos se llaman aniones.
La teoría de Lewis también introduce el concepto de estructura de Lewis, que es una representación gráfica de los electrones de valencia de un átomo. En la estructura de Lewis, los electrones de valencia se representan como puntos alrededor del símbolo del átomo.
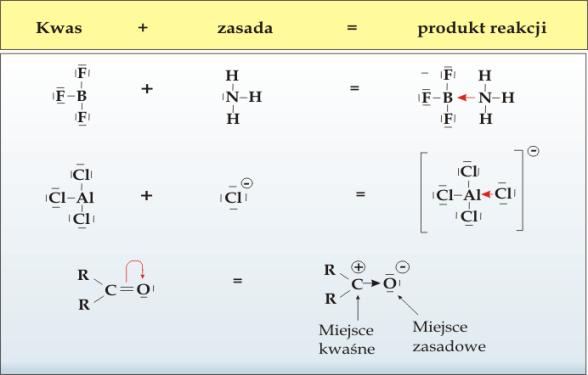
Otro concepto importante que introduce la teoría de Lewis es el de enlace covalente coordinado, también conocido como enlace dativo. Este enlace se forma cuando un átomo dona ambos electrones de un enlace covalente, mientras que el otro átomo no dona ningún electrón.
Resumen
- La teoría de Lewis explica cómo los átomos interactúan entre sí para formar enlaces químicos.
- Los átomos pueden compartir electrones para formar enlaces covalentes, o bien transferir electrones para formar enlaces iónicos.
- La teoría de Lewis introduce el concepto de pares de electrones no compartidos.
- Los átomos que tienen la tendencia a ceder electrones y formar iones positivos se llaman cationes.
- Los átomos que tienen la tendencia a aceptar electrones y formar iones negativos se llaman aniones.
- La estructura de Lewis

Principios de Lewis: conócelos aquí
La Teoría de Lewis, también conocida como la teoría de la estructura de Lewis, es una teoría que se utiliza para describir la formación de enlaces químicos entre átomos. Esta teoría se basa en los principios de electronegatividad y en la idea de que los átomos comparten electrones para formar enlaces.
A continuación, se presentan los principales principios de la teoría de Lewis:
1. Regla del octeto
La regla del octeto establece que los átomos tienden a completar su última capa de electrones, que debe contener 8 electrones, para lograr una configuración estable. Esto se logra mediante la pérdida, ganancia o compartición de electrones con otros átomos.
2. Enlace covalente
El enlace covalente se produce cuando dos átomos comparten un par de electrones para completar su última capa de electrones. Este tipo de enlace se forma entre átomos con electronegatividades similares.
3. Enlace iónico
El enlace iónico se produce cuando un átomo pierde electrones y otro átomo los gana para completar su última capa de electrones. Este tipo de enlace se forma entre átomos con grandes diferencias de electronegatividad.
4. Enlace coordinado
El enlace coordinado se produce cuando un átomo dona un par de electrones a otro átomo que los necesita para completar su última capa de electrones. Este tipo de enlace se forma entre átomos con diferencias de electronegatividad moderadas.
Conocer los principios de esta teoría es fundamental para comprender la química a nivel molecular.

Teoría de Lewis: Enlaces Químicos Explicados
La teoría de Lewis, desarrollada por el químico Gilbert N. Lewis en 1916, es una explicación de cómo se forman los enlaces químicos entre los átomos. Esta teoría es muy importante en la química, ya que nos ayuda a entender cómo los elementos se combinan para formar diferentes compuestos.
¿Qué son los electrones?
Antes de entrar en detalles sobre la teoría de Lewis, es importante entender qué son los electrones. Los electrones son partículas subatómicas que se encuentran alrededor del núcleo del átomo. Los electrones tienen carga negativa y se mueven en órbitas alrededor del núcleo.
¿Qué es un enlace químico?
Un enlace químico es una fuerza que mantiene unidos a dos o más átomos. Los átomos se unen para formar moléculas y compuestos. Hay diferentes tipos de enlaces químicos, como el enlace iónico, el enlace covalente y el enlace metálico.
La teoría de Lewis
La teoría de Lewis se basa en la idea de que los átomos quieren tener ocho electrones en su capa externa. Esto se conoce como la regla del octeto. Cuando un átomo tiene ocho electrones en su capa externa, se dice que está «lleno» y es estable. Los átomos pueden lograr un octeto completo de diferentes maneras, dependiendo de su configuración electrónica.
Según la teoría de Lewis, los electrones se pueden representar mediante puntos o «puntos de Lewis». Los puntos de Lewis se colocan alrededor del símbolo del átomo para representar los electrones de la capa externa. Por ejemplo, el oxígeno tiene seis electrones de valencia, por lo que se puede representar mediante dos puntos en la parte superior y cuatro puntos en la parte inferior del símbolo del oxígeno.
La teoría de Lewis también nos permite entender cómo se forman los enlaces químicos. Cuando dos átomos se unen para formar un enlace covalente, comparten electrones para lograr un octeto completo. Por ejemplo, el hidrógeno tiene un solo electrón en su capa externa, por lo que puede compartir ese electrón con otro átomo de hidrógeno
Modelo Atómico de Lewis: Aportes Clave
La Teoría de Lewis es una teoría propuesta por Gilbert Newton Lewis en el año 1916, que se utiliza para explicar cómo los átomos se combinan entre sí para formar moléculas. Este modelo se basa en la idea de que los átomos están formados por un núcleo central con electrones en órbita a su alrededor.
El Modelo Atómico de Lewis es una de las herramientas clave utilizadas para aplicar la Teoría de Lewis en química. Este modelo se basa en la idea de que los átomos comparten electrones para formar enlaces químicos. Para representar esta idea, se utilizan símbolos de átomos y puntos para representar los electrones en las capas exteriores de los átomos.
Aportes Clave del Modelo Atómico de Lewis
- El Modelo Atómico de Lewis ayuda a los estudiantes a comprender cómo los átomos se combinan para formar moléculas y compuestos químicos.
- El modelo ayuda a predecir la estructura molecular de los compuestos y la polaridad de los enlaces químicos.
- Este modelo también es útil para entender la reactividad química de los compuestos y cómo los átomos pueden ganar o perder electrones para formar iones.
- El modelo también se utiliza para ilustrar la formación de enlaces covalentes y enlaces iónicos, así como la formación de moléculas polares y no polares.
- El Modelo Atómico de Lewis también es útil para entender la geometría molecular y la hibridación orbital en los átomos.
la Teoría de Lewis nos proporciona una base sólida para entender la forma en que los átomos interactúan entre sí. Sus conceptos de enlace covalente y octeto permiten predecir la estabilidad y la reactividad de moléculas y compuestos. A pesar de haber sido desarrollada hace más de un siglo, sigue siendo una herramienta esencial para la química moderna y la comprensión de la estructura de la materia.
Este contenido también puede ser encontrado cuando buscas Teoria lewisa

Carmen García es antropóloga social y cultural con experiencia en investigación etnográfica en América Latina y África. Sus principales intereses de investigación incluyen las culturas indígenas, la identidad cultural, la migración y el género.
También te puede interesar

Descubre la teoría monogenista del poblamiento de América

Descubre la fascinante historia detrás de La Teoría del Todo, la película que te cautivará

Las etapas del desarrollo según Arnold Gesell: Una teoría clave para entender el crecimiento humano

Descubre la Teoría Evolutiva Moderna: La clave para entender la evolución

Descubre la Teoría de Einstein sobre el Espacio-Tiempo